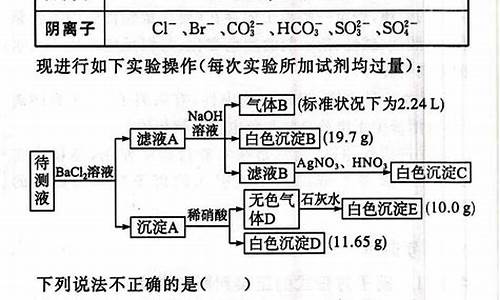
您现在的位置是: 首页 > 招生信息 招生信息
离子共存高考真题_高考离子共存问题规律总结
tamoadmin 2024-05-18 人已围观
简介1.「高考化学-离子共存问题」如果溶液中有ClO-, CO32-, C6H5-这些离子,能共存伐?首先,硫酸根离子,亚硫酸根离子,碳酸根离子,氯离子,氢氧根离子,这些离子和银离子都是不共存的,高中阶段所学离子中,和这些离子都不共存的离子貌似只有银离子了,其中氯离子是最特别的,只有银离子和氯离子是不共存的,其他金属阳离子和氯离子是不能沉淀的,所以检验银离子的时候就用氯离子来检验(当然要注意排除其他离
1.「高考化学-离子共存问题」如果溶液中有ClO-, CO32-, C6H5-这些离子,能共存伐?
首先,硫酸根离子,亚硫酸根离子,碳酸根离子,氯离子,氢氧根离子,这些离子和银离子都是不共存的,高中阶段所学离子中,和这些离子都不共存的离子貌似只有银离子了,其中氯离子是最特别的,只有银离子和氯离子是不共存的,其他金属阳离子和氯离子是不能沉淀的,所以检验银离子的时候就用氯离子来检验(当然要注意排除其他离子的干扰),这是题外话了...
然后,你所说的“溶解呈酸性以后碳酸银等物质是能溶于酸性溶液的”,这没有错,不过要搞清楚的一点,这是很多人都混淆的一点,溶液中存在酸根离子,不代表溶液呈酸性,而酸性的代表只有一个,就是氢离子,当然碱性的代表是氢氧根,而你题目中是存在氢氧根离子的,所以该溶液不呈酸性而是呈碱性的。
另外,氯化银沉淀是不溶于酸性溶液的。
记住记住,不是有酸根就是酸性,是看氢离子的,这是高考常常用来设陷阱的地方,要小心注意~
祝高考成功!~呵呵
「高考化学-离子共存问题」如果溶液中有ClO-, CO32-, C6H5-这些离子,能共存伐?
离子共存之一
所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。一般注意以下几点:
①在强酸性溶液中,不能大量存在弱酸根离子:如CO32-、HCO3-、S2-、HS-、SO32-、SiO32-、AlO2-、F-等,也不能有大量的OH-。
②强碱性溶液中,不能大量存在弱碱金属离子。如:Mg2+、Fe2+、Al3+、Cu2+及NH4+等,也不能大量存在H+及酸式根离子:HCO3-、HSO3-、HS-、H2PO4-等。
③能发生氧化还原反应的离子也不能共存:如:Fe3+?与I-、Cu2+与I2,H+、Fe2+与NO3-、H+与S2O32-,ClO-与S2-,ClO-与Fe2+。H+、I-与NO3-,H+、I-与SO32-或S2-等。
④能形成络离子的也不能共存:如:Fe2+与SCN-,Ag+与S2O32-,Fe3+与C6H5O-等。
离子共存之二
所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
(1)生成难溶物或微溶物:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等不能大量共存。
(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-、S2-、HS-、HSO3-、SO32-等不能大量共存。
(3)生成难电离的物质:如H+与Ac-、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水,这些离子不能大量共存。
(4)发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+ 、SO32-等)不能大量共存。
注意Fe2+与Fe3+可以共存。
(5)形成配合物:如Fe3+与SCN-反应生成配合物而不能大量共存。
2.附加隐含条件的应用规律:
(1)溶液无色透明时,则溶液中肯定没有有色离子。常见的有色离子是Cu2+、Fe3+、Fe2+、MnO4-等。
(2)强碱性溶液中肯定不存在与OH-起反应的离子。
(3)强酸性溶液中肯定不存在与H+起反应的离子。
次氯酸根离子 碳酸根离子 苯酚离子 三者可以共存。
类似的可以发生的反应是 碳酸+ 次氯酸根 /碳酸+ 苯酚离子 产物是碳酸氢根 + 次氯酸/苯酚
次氯酸+碳酸根 / 苯酚 +碳酸根 产物是 次氯酸根 /苯酚离子 + 碳酸氢根
另外你追问别人的题目我也看了,这个答案在高考题目中是毫无争议的,但是作为初赛题就好说了,因为情况太复杂,真要说的话起码得半节课。另外不得不说的是初赛题的答案不见得就靠谱。









